Cytometr przepływowy CANTO II

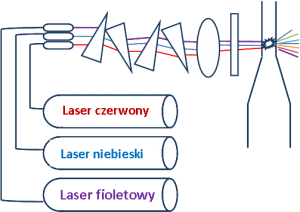
Cytometr przepływowy BD FACS Canto II wyposażony w trzy lasery dające możliwość oznaczania jednocześnie 8 parametrów w jednej próbce.
Cytometria przepływowa umożliwia ilościowe określenie populacji i subpopulacji komórek, ich cech morfologicznych oraz stanów czynnościowych. Dzięki znakowaniu przeciwciałami monoklonalnymi znakowanymi z barwnikami fluorescencyjnymi, cytometria umożliwia ocenę immunofenotypu .
PRZYKŁADY WYKORZYSTANIA BD FACS Canto II
- oznaczanie potencjału błonowego mitochondriów przy użyciu barwnika JC-1 w różnych typach komórek
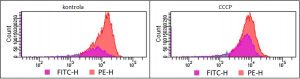
Do oznaczania depolaryzacji mitochondriów wykorzystywano znakowanie komórek kationowym barwnikiem JC1, który jest fluorescencyjną sondą potencjału mitochondrialnego. Barwnik ten tworzy agregaty (fluoryzujące czerwono) jedynie w komórkach posiadających nieuszkodzone mitochondria o wysokim potencjale elektrycznym błony. W przypadku depolaryzacji mitochondriów JC1 tworzy zielono fluoryzujące monomery.
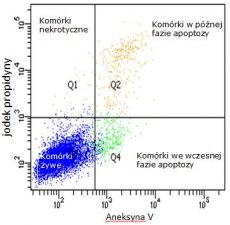
- ocena poziomu apoptozy komórek przy użyciu barwników aneksyny V i jodku propydyny.
Cechą charakterystyczną komórki apoptotycznej jest przebudowa błony komórkowej. Dochodzi do zaburzenia asymetrii fosfolipidów, znajdujących się w błonie komórkowej. W komórkach apoptotycznych fosfatydyloseryna jest eksponowana na zewnętrznej błonie komórkowej i wiąże się z aneksyną V. Jodek propidyny barwi DNA wnikając do komórek martwych przez poluźnioną błonę komórkową.
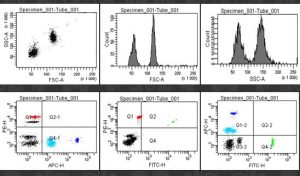
- fenotypowanie populacji komórek
Dzięki przeciwciałom monoklonalnych połączonym z barwnikami fluorescencyjnymi możliwa jest ocena immunofenotypu związanego z obecnością antygenów zlokalizowanych na powierzchni błony komórkowej i dzięki permeabilizacji można również dokonywać oceny antygenów cytoplazmatycznych i jądrowych.
- Ocena wybranych mikrocząstek w różnych chorobach
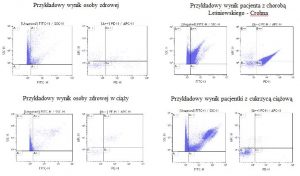
W różnych schorzeniach obserwuje się podniesiony poziom mikrocząstek w porównaniu z osobami zdrowymi.
W przykładowym badaniu oceniono całkowitą ilość mikrocząstek krążących związaną z Aneksyny V sprzężonej z barwnikiem fluorescencyjnym FITC. Przeciwciało CD41 sprzężone z fikoerytryną PE – oznacza mikrocząstki pochodzenia płytkowego. A przeciwciało CD62L – sprzężone z APC – oznacza mikrocząstki z aktywowanych płytek.


